La notazione degli isotopi è la seguente:
188 O 168 O ? questi sono due isotopi dell'ossigeno aventi lo stesso numero atomico (8) ma differente numero di massa, rispettivamente 18 e 16.
Tali isotopi vengono chiamati ossigeno-16 e ossigeno-18.
L'idrogeno è l'unico elemento i cui isotopi non prendono il nome dall'elemento stesso ma sono dotati di nome proprio. Gli isotopi dell'idrogeno sono tre: il prozio 1H, il deuterio 2H e il trizio 3H.

Cenni di chimica nucleare
La maggior parte degli elementi possiede due o più isotopi stabili ma non tutti gli isotopi sono stabili, esistono anche gli isotopi instabili. Gli isotopi instabili sono quelli che per stabilizzarsi vanno incontro a decadimento radioattivo emettendo raggi

I nuclei che hanno un eccesso di protoni vanno incontro ad un tipo di decadimento mentre i nuclei con un eccesso di neutroni vanno incontro ad un altro tipo di decadimeno.
Decadimento
Il decadimento positronico o
Decadimento
Nel decadimento
Decadimento
Il decadimento α comporta l'emissione di una particella formata da due protoni e due neutroni (nucleo di He). Queste particelle sono molto grosse e cariche di energia a tal punto che quando avviene il decadimento la particella α rilascia subito tutta la sua energia nel breve spazio che la circonda.
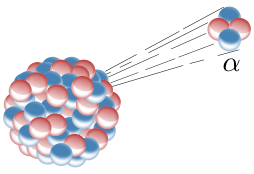
Il decadimento α viene utilizzato per fare radioterapia perché emette un'energia così intensa da frantumare le cellule tumorali e danneggiarle irreparabilmente.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] - Orbitali molecolari
- Legami chimici [4] - Legame covalente polare e dativo
- Legami chimici [5] - Legame ionico
- Legami chimici [6] - Legame metallico]


