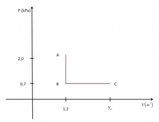
Una certa quantit di gas perfetto costituita da molecole formate da un solo atomo. Il numero delle molecole pari a
- Qual il valore dellenergia interna del gas?
- Qual il nuovo valore dellenergia interna del gas?
Risoluzione quesito 1
Calcoliamo lenergia interna del gas con la formula
Risoluzione quesito 2
Nel caso in cui il gas non possa considerarsi un gas perfetto, la sua energia interna data dalla somma dellenergia cinetica (positiva) e dallenergia potenziale (negativa) di tutte le molecole:
Il valore dellenergia cinetica trovato precedentemente corrisponde allenergia cinetica totale, poich in un gas perfetto lenergia interna corrisponde allenergia cinetica delle particelle.
Di conseguenza, per calcolare lenergia potenziale del gas reale, calcoliamo il 2,6% del valore numerico dellenergia interna precedente:
Consideriamo, per, che lenergia potenziale negativa:
Lenergia cinetica delle molecole corrisponde a quella trovata precedentemente, cio allenergia interna del gas perfetto:
Possiamo quindi calcolare la nuova energia potenziale: