Riassunto lezione precedente
Nella sezione precedente abbiamo visto che due atomi aventi una differenza di elettronegatività compresa tra 0,4 e 1,7 condividono un doppietto elettronico che sarà localizzato sull'atomo più elettronegativo, conferendogli una carica parziale negativa.Cosa succede quando si instaura un legame tra due atomi che hanno una differenza di elettronegatività maggiore di 1,7. In questo caso l'atomo più elettronegativo strappa definitivamente uno o più elettroni dall'atomo meno elettronegativo portando alla formazione di due ioni di carica opposta. Si ricorda dunque il concetto di elettronegatività.
L'elettronegatività è una misura della tendenza di un atomo in una molecola ad attrarre su di sé gli elettroni condivisi di un legame.
Un atomo è tanto più elettronegativo quanto è maggiore l'energia di ionizzazione (cioè tanto più difficilmente tende a perdere i suoi elettroni), e quanto è più grande e negativa l'affinità elettronica (tanto più facilmente tende ad acquistare elettroni).
Una volta formatisi il catione e l'anione si attraggono elettrostaticamente. Nel solido tali ioni si dispongono secondo un reticolo cristallino ordinato che permette di rendere massima l'attrazione tra le particelle di carica opposta e minima la repulsione tra quelle della stessa carica.
Legame ionico
Il legame ionico è un'attrazione elettrostatica che si instaura tra due ioni di carica elettrica opposta, ossia un catione (ione positivo) ed un anione (ione negativo). Una volta formatisi il catione e l'anione si attraggono elettrostaticamente. Nel solido tali ioni si dispongono secondo un reticolo cristallino ordinato che permette di rendere massima l'attrazione tra le particelle di carica opposta e minima la repulsione tra quelle della stessa carica.Si definisce dunque legame ionico quello che si forma fra atomi che possiedono una forte differenza di elettronegatività, ovvero in quei casi in cui i valori di elettronegatività sia uguale o superiore a 1.7.
Questo tipo di legame si instaura tra un metallo (elemento poco elettronegativo) ed un non metallo (elemento molto elettronegativo). Il metallo cede uno o più elettroni al non metallo portando alla formazione rispettivamente di uno ione positivo detto catione ed uno ione negativo detto anione.
Un esempio di legame ionico è dato dal cloruro di sodio (NaCl). Il cloro ha una elettronegatività molto più alta del sodio (3,0 vs 0,9). Il sodio ha solo un elettrone di valenza mentre il cloro ha sette elettroni di valenza. Il composto NaCl si forma dalla cessione dell'elettrone di valenza del sodio al cloro, portando alla formazione del catione Na+ e dell'anione Cl-. In questo modo si instaura un'attrazione elettrostatica tra i due elementi che raggiungono così l'ottetto (Figura 1).
[caption id="attachment_16863" align="alignleft" width="593"]![]() Figura1. Formazione del legame ionico tra sodio e cloro
Figura1. Formazione del legame ionico tra sodio e cloro
Composti ionici
I composti che sono caratterizzati dall'essere creati attraverso legami ionici vengono denominati composti ionici. Questi composti sono tutti solidi a temperatura ambiente. Possiedono inoltre dei punti di fusione molto elevati e dei punti di ebollizione ancora più elevati, per cui è veramente difficile andare a realizzare il passaggio di stato da solido a vapore. Questo fenomeno va ad indicare che l'attrazione tra gli ioni è molto forte, per cui è necessaria una maggiore energia per andare a separarli. Sono materiali in genere duri, ma anche fragili. Risultano essere solubili in acqua e in solventi polare; mentre in solventi apolari risultano insolubili. Infine sono degli isolanti allo stato solido e dunque conduttori allo stato fuso.
Differenza tra legame covalente e legame ionico
La differenza fondamentale che esiste tra il legame covalente e il legame ionico è che nel legame covalente si crea un vincolo diretto tra i due atomi che si manifesta come la condivisione di un doppietto elettronico; nel legame ionico ciò non si verifica in quanto cationi e anioni sono indipendenti gli uni dagli altri e sono uniti soltanto dall'attrazione elettrostatica.In un legame ionico non si ha la formazione di un orbitale molecolare o di una molecola ma si ha la formazione di un reticolo cristallino.
I composti ionici non sono formati da molecole ma bensì da ioni di carica opposta che si dispongono a formare reticoli cristallini tridimensionali in cui le forze di repulsione tra gli ioni di stessa carica sono minime, mentre le forze di attrazione tra ioni di carica opposta sono massime. I composti ionici sono solidi (Figura 2).
[caption id="attachment_16862" align="alignleft" width="555"]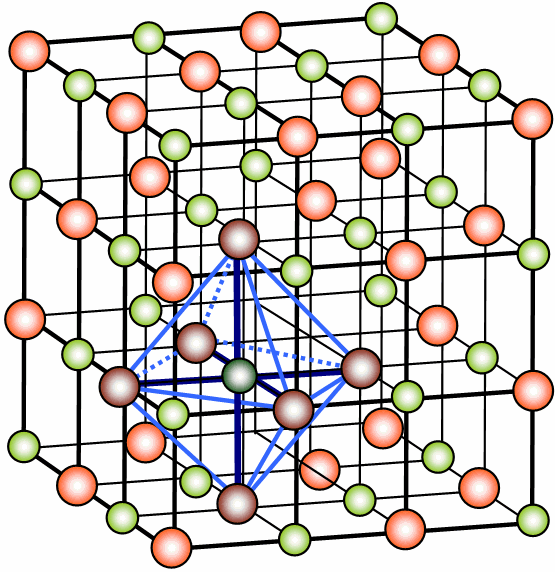 Figura 2. Reticolo cristallino del cloruro di sodio (verde: Na; rosso: Cl)
Figura 2. Reticolo cristallino del cloruro di sodio (verde: Na; rosso: Cl)
L'energia liberata dalla formazione del reticolo cristallino per effetto dell'interazione elettrostatica tra ioni positivi e ioni negativi è definita energia reticolare. L'energia reticolare dipende dalle caratteristiche degli ioni: aumenta all'aumentare della carica degli ioni e al diminuire della loro dimensione.
È importante sapere che anche i composti covalenti, come il ghiaccio e lo zucchero, formano un reticolo cristallino tridimensionale quando presenti allo stato solido. In questo caso, però, il reticolo si forma grazie alla presenza di legami intermolecolari. I legami intermolecolari sono più deboli dei legami ionici e l'energia necessaria per fondere un composto covalente è minore dell'energia necessaria per fondere un composto ionico (l'energia necessaria per fondere il sale (composto ionico) è maggiore dell'energia necessaria per fondere lo zucchero (composto covalente)).
Potrebbe interessarti anche
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Configurazione elettronica
- Tavola periodica degli elementi
- Gli isotopi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [3] - Orbitali molecolari
- Legami chimici [4] - Legame covalente polare e dativo

![Legami chimici [6] - Legame metallico](https://cdn.skuola.net/shared/thumb/159x141/news_foto/2017/07/legame-metallico.png)
![Legami chimici [4] - Legame covalente polare e dativo](https://cdn.skuola.net/shared/thumb/159x141/news_foto/2017/07/legame-covalente-omopolare.png)