Consideriamo un liquido, ad esempio, l’acqua, chiuso all’interno di un recipiente, riempito per metà da esso. Nella parte superiore del recipiente sono presenti molecole di acqua allo stato gassoso, evaporate dal liquido sottostante.
La quantità di molecole in fase di vapore influenza l’evaporazione stessa del liquido; le molecole di gas, infatti, vendo a contatto con la superficie dell’acqua possono tornare allo stato liquido.
In particolare, all’inizio dell’evaporazione sono presenti poche particelle in fase gassosa, quindi le molecole che si trovano sulla superficie del liquido che che possono staccarsi da esso, passando alla fase di gas, sono più numerose di quelle che vi rientrano.
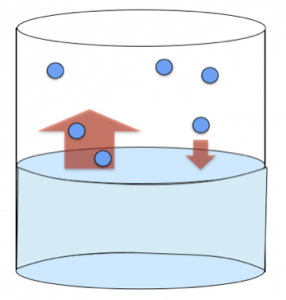
Con il passare del tempo, le particelle che passano alla fase gassosa aumentano sempre di più in numero, e ciò fa si che vi sia un aumento anche nel numero di particelle che si trovano a contatto con la superficie del liquido, e che quindi possono ritornare in esso.
Questo processo continua fino a quando il numero di particelle che passa alla fase gassosa uguaglia il numero di particelle che rientra in fase liquida; si stabilisce, così, un equilibrio dinamico tra le due fasi, e da punto di vista macroscopico sembra che l’evaporazione dell’acqua sia terminata.
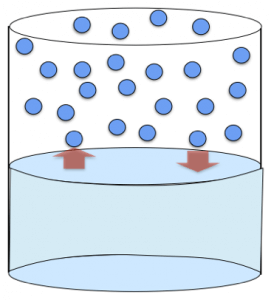
Quando viene raggiunta questa situazione di equilibrio, il gas presente nella parte superiore del recipiente esercita una pressione sul liquido sottostante e sulle pareti del contenitore; questa pressione viene definita pressione (o tensione) di vapore saturo, e rappresenta la massima pressione che quel gas può esercitare ad una precisa temperatura.
Quando la pressione di vapore del gas uguaglia la pressione atmosferica, la temperatura raggiunta dal gas si definisce temperatura di ebollizione.
Nel caso dell’acqua, ad esempio, la pressione di vapore uguaglia quella atmosferica quando, al livello del mare, la temperatura del liquido raggiunge i 100° C.
Come sappiamo, la pressione atmosferica varia in base all’altitudine a cui ci troviamo. Al livello del mare, ad esempio, la pressione atmosferica è minore di quella che si ha in montagna, di conseguenza la temperatura di ebollizione dell’acqua al livello del mare sarà minore rispetto a quella che si ha ad altitudini maggiori.
In particolare, possiamo notare la presenza della pressione di vapor saturo anche nel fenomeno dell’ebollizione di un liquido. Infatti, quando un liquido viene scaldato da una sorgente di calore, al suo interno si formano delle bollicine di vapore, al cui interno si ha una pressione pari esattamente a quella del vapore saturo.
Con l’aumento della temperatura del liquido, continuando a fornire calore, la pressione di vapore saturo aumenta, fino al raggiungimento della pressione atmosferica; quando questo accade, le bollicine vengono spinte verso la superficie dl liquido (grazie alla spinta di Archimede), e possono distaccarsi da esso, dando luogo, così, all’ebollizione.
La sublimazione e il brinamento
In determinate condizioni di temperatura e pressione è possibile il passaggio di stato diretto dallo stato gassoso a quello solido, e viceversa, dallo stato solido a quello gassoso.
Nel caso di sostanze che presentano un’alta pressione di vapore a temperatura ordinaria, e che si trovano allo stato solido, può avvenire il fenomeno della sublimazione, cioè il passaggio diretto dallo stato solido a quello aeriforme.
Tra le sostanze più soggette a brinamento ricordiamo lo iodio e la canfora.
La trasformazione inversa alla sublimazione è il brinamento, cioè il passaggio diretto di un gas allo stato solido. Il brillamento è particolarmente evidente nella formazione della brina sulla superficie delle foglie delle piante; ciò è dovuto al fatto che il vapore acqueo che si trova nell’aria, a causa delle basse temperature, si trasforma in cristalli di ghiaccio che si depositano, poi, sulle superfici con cui vengono a contatto.
Il brinamento può essere osservato anche nel caso dello zolfo; in seguito a raffreddamento a pressione atmosferica, questo passa allo stato solido dando luogo a dei depositi sul terreno.
Potrebbero interessarti
Appunti: I passaggi di stato: fusione e solidificazione
Appunti: I passaggi di stato: vaporizzazione e condensazione
Appunti: La temperatura critica
