Abbiamo già visto che è possibile far avvenire una passaggio di stato variando la temperatura del corpo in esame. Ad esempio, per condensare un gas, cioè farlo passare alla fase liquida, si può raffreddare il gas mantenendo costante la sua pressione.
Nel caso della condensazione, però, è possibile agire anche modificando la pressione di un gas; infatti, se abbiamo un gas che si trova in un recipiente contenente anche la sostanza allo stato liquido, e comprimiamo il gas, cioè aumentiamo la sua pressione, parte di questo gas passerà alla fase liquida.
Questo è dovuto al fatto che il valore di pressione che viene raggiunto dal gas non può superare il valore della tensione di vapore, e per questo necessariamente devono diminuire le particelle di gas che occupano quel volume; per questo, alcune di esse, quelle a contatto con la superficie del liquido, rientreranno in esso.
La condensazione mediante variazione di pressione, però, non avviene per tutti i gas. Ad esempio, l’aria che respiriamo, anche se sottoposta a pressioni molto elevate, con passa alla fase liquida.
Nel caso di altri gas, invece, la condensazione tramite variazione di pressione avviene solo a determinate temperature; in particolare, vi è una temperatura, definita temperatura critica, e variabile per ogni sostanza, che rappresenta il valore limite di temperatura per il quale può avvenire la condensazione di tale gas.
La definizione di temperatura critica, inoltre, permette di distinguere due categorie di sostanze gassose, i vapori e i gas.
- I vapori sono sostanze aeriformi caratterizzate dal fatto possedere una temperatura, allo stato naturale, minore della loro temperatura critica; di conseguenza essi possono condensare se sottoposti a pressione;
- i gas, invece, si trovano ad una temperatura maggiore della loro temperatura critica; quindi, anche se sottoposti ad elevate pressioni, non possono condensare.
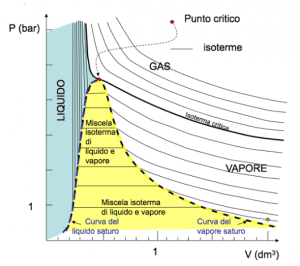
Nei diagrammi di fase è possibile esaminare le proprietà del passaggio di stato da liquido ad aeriforme e viceversa. In tali diagrammi vi è un asse verticale in cui si riportano i valori delle pressioni, e un asse orientale dove invece si hanno valori del volume della sostanza.
Le curve presenti nel diagramma vengono definite isoterme, in questo descrivono trasformazioni della sostanza a temperatura costante.
Il vapore acqueo
Il vapore acqueo si trova ovunque nell’ambiente in cui viviamo e nell’aria che respiriamo; in base all’altezza cui si trova esso è sottoposto a pressioni differenti.
La sua temperatura critica è di 374°C, per questo esso condensa facilmente se compresso a temperatura ambiente.
Nei punti in cui la sua pressione supera la tensione di vapore (alla temperatura ambiente cui si trova), il vapore tende a condensare. In particolare, poiché ci troviamo in aria, la condensazione avviene attorno a delle particelle di polvere o di uno che si trovano nell’aria; queste vengono definite nuclei di condensazione; questo fenomeno da luogo alle nuvole o alle nebbie.
Vi sono molti fenomeni atmosferici che sono determinati dalla condensazione del vapore acqueo; ad esempio la brina, dovuta al brinamento del vapore che passa alla fase solida; o le piogge, dovute ad un accumulo di particelle di vapore che, anche all’interno delle nubi, passano alla fase liquida, e ricadono giù; o la neve dovuta, anch’essa, all’accumulo di particelle di vapore nelle nubi, che si trasformano in cristalli di ghiaccio se la temperatura esterna è intorno agli 0°C.
E’ possibile tener conto della quantità di vapore acqueo presente in un determinato ambiente rapportando il valore della pressione di vapore acqueo misurata in un determinato luogo e in un preciso istante, con la tensione del vapore saturo dell’acqua nelle medesime condizioni.
La grandezza fisica che si ottiene prende il nome di umidità relativa, ed è espressa dalla seguente formula:
$ H_r = frac(p_(acqua))(p_(v. saturo)) $
Potrebbero interessarti
Appunti: Il vapor saturo, sublimazione e brinamento
Appunti: Il principio zero della termodinamica
