La vaporizzazione e la condensazione sono passaggi di stato che riguardano lo stato liquido e quello gassoso; in particolare, si ha vaporizzazione quando una sostanza allo stato liquido passa a quello gassoso, e condensazione quando un gas passa alla fase liquida.
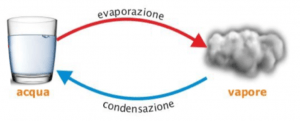
Così come avviene pera la fusione e la solidificazione, anche i passaggi di stato che riguardano liquidi e gas possono avvenire a causa di una differenza di temperatura, cioè attraverso una passaggio di calore.
Ad esempio, se abbiamo una pentola piena d’acqua sui fornelli, noteremo sul coperchio di essa la formazione di goccioline d’acqua: infatti, l’acqua nella pentola tende ad evaporare, in quanto essa viene riscaldata dal calore del fornello; quando, però, raggiunge la superficie del coperchio, che si trova ad una temperatura molto più bassa, il vapore che si era formato ritorna allo stato liquido.
La vaporizzazione
Così come abbiamo visto per gli altri passaggi di stato, anche in questo caso possiamo esaminare delle leggi che descrivono l’evaporazione di un gas:
- tutti i liquidi presentano, ad una determinata pressione, una temperatura particolare alla quale avviene la loro vaporizzazione, detta appunto temperatura di ebollizione;
- durante tutta la durata del fenomeno di vaporizzazione la temperatura del liquido si mantiene costante;
Anche in questo caso, il calore che viene fornito inizialmente al liquido serve per aumentare la sua temperatura (e quindi anche l’energia cinetica media delle particelle), fino al raggiungimento della temperatura di ebollizione;
quando questa temperature viene raggiunta, il calore fornito non andrà più ad aumentare la temperatura, ma servirà per rompere i legami tra le particelle del liquido, permettendogli, così, di passare allo stato gassoso.
- l’energia, o il calore, necessario per permettere ad una sostanza di passare dallo stato liquido a quello gassoso, che si trova alla temperatura di ebollizione, è direttamente proporzionale ala massa del liquido; il valore di tale energia è espresso dalla seguente formula:
$∆E = L_v * m $
dove la costante Lv è definita calore latente di vaporizzazione; essa è numericamente uguale alla quantità di energica necessaria per far passare allo stato di vapore 1 kg di una determinata sostanza.
Ebollizione ed evaporazione
Notiamo che la vaporizzazione può essere rappresentata da due fenomeni simili, l’ebollizione e l’evaporazione.
La differenza tra i due fenomeni sta nel fatto che, nel caso dell’ebollizione la temperatura del liquido rimane costante per la durata del fenomeno; nel caso dell’evaporazione, invece, ciò non avviene.
Nel caso del calore latente di vaporizzazione, in particolare, si fa riferimento alla vaporizzazione di una sostanza con mantenimento della temperatura costante durante il fenomeno.
Da notare che durante la vaporizzazione non si ha un passaggio allo stato gassoso di tutte le molecole di liquido contemporaneamente; infatti, quando il liquido viene riscaldato possono passare allo stato di vapore solo le particelle che si trovano sulla superficie di esso, e che hanno raggiunto una velocità (rivolta verso l’alto) sufficientemente elevata da permettere di rompere i legami intermolecolari.
Con l’evaporazione, quindi, si distaccano dal liquido le particelle più veloci, con conseguente diminuzione dell’energia cinetica media delle particelle del liquido.
La condensazione
La condensazione, come abbiamo già visto, è il passaggio di stato inverso alla vaporizzazione, cioè il passaggio dalla fase gassosa a quella liquida.
Anche in questo caso, vediamo che l’energia che occorre fornire per permettere ad un liquido di passare allo stato gassoso è uguale, in modulo, all’energia che la sostanza gassosa cede all’ambiente quando essa passa allo stato liquido durante la condensazione.
Poiché l’energia viene ceduta dal sistema all’ambiente, il calore scambiato avrà segno negativo; la formula che lo descrive è la seguente:
$∆E = L_v * m $
Potrebbero interessarti
Appunti: I passaggi di stato: fusione e solidificazione
Appunti: Il vapor saturo, sublimazione e brinamento
