Gli isotopi di un elemento sono atomi aventi lo stesso numero atomico ma diverso numero di massa. Gli studi sulla radioattività e i raggi anodici misero in evidenza l’esistenza di atomi dello stesso elemento ma che differivano per numero di neutroni. Gli isotopi occupano la stessa posizione nella tavola degli elementi e condividono le proprietà chimiche dell’elemento in questione. Quindi gli isotopi hanno lo stesso numero di protoni ma un diverso numero di neutroni.
La notazione degli isotopi è la seguente:
188 O 168 O → questi sono due isotopi dell’ossigeno aventi lo stesso numero atomico (8) ma differente numero di massa, rispettivamente 18 e 16. Tali isotopi vengono chiamati ossigeno-16 e ossigeno-18.
L’idrogeno è l’unico elemento i cui isotopi non prendono il nome dall’elemento stesso ma sono dotati di nome proprio. Gli isotopi dell’idrogeno sono tre: il prozio 1H, il deuterio 2H e il trizio 3H.

Cenni di chimica nucleare
La maggior parte degli elementi possiede due o più isotopi stabili ma non tutti gli isotopi sono stabili, esistono anche gli isotopi instabili. Gli isotopi instabili sono quelli che per stabilizzarsi vanno incontro a decadimento radioattivo emettendo raggi α, β o γ. Nell’immagine seguente è rappresentata una nuvola colorata con dei quadratini neri che rappresentano i nuclei stabili, che non decadono. Ci sono però dei nuclei che hanno neutroni o protoni in eccesso e sono instabili e decadono.

I nuclei che hanno un eccesso di protoni vanno incontro ad un tipo di decadimento mentre i nuclei con un eccesso di neutroni vanno incontro ad un altro tipo di decadimeno.
Decadimeno β+
Il decadimento positronico o β+ avviene nei nuclei con un eccesso di protoni. In seguito al decadimento viene emesso un positrone, che è l’antiparticella dell’elettrone, un neutrone e un neutrino.
$ \p \rightarrow n + e^{+}+v\ $
Decadimeno β–
Nel decadimento β– un neutrone si trasforma in un protone e in un elettrone più un antineutrino.
$ \n \rightarrow p + e^{-}+\overline{V}_{e}\ $
Decadimeno α
Il decadimento α comporta l’emissione di una particella formata da due protoni e due neutroni (nucleo di He). Queste particelle sono molto grosse e cariche di energia a tal punto che quando avviene il decadimento la particella α rilascia subito tutta la sua energia nel breve spazio che la circonda.
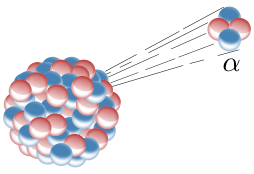
Il decadimento α viene utilizzato per fare radioterapia perché emette un’energia così intensa da frantumare le cellule tumorali e danneggiarle irreparabilmente.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Tavola periodica degli elementi
Ogni elemento chimico della tavola periodica viene individuato attraverso un simbolo costituito da una o due lettere (di cui la prima è maiuscola e la seconda è minuscola) e la sua posizione viene assegnata secondo dei criteri ben precisi. In ogni casella sono indicate le seguenti caratteristiche di un elemento chimico (che vedremo in dettaglio successivamente):
- Numero atomico;
- Stato dell’elemento (S = solido; L = liquido; G = gas; A = artificiale)
- Elettronegatività;
- Stati di ossidazione;
- Peso atomico;
- Configurazione elettronica;
- Nome

La tavola periodica, come la studiamo oggi, è la stesura finale di un lavoro iniziato da Mendeleev, chimico russo. Egli organizzò gli elementi all’epoca conosciuti disponendoli secondo numero atomico crescente in riga, andando a capo quando inizia il riempimento degli orbitali di un altro livello, e secondo proprietà simili in colonna.
Ogni riga è detta periodo e corrisponde al riempimento di un livello energetico, mentre ogni colonna corrisponde al gruppo. Gli elementi appartenenti allo stesso gruppo hanno la stessa configurazione elettronica, ossia hanno lo stesso numero di elettroni di valenza, che sono gli elettroni presenti nel livello energetico esterno, chiamato guscio di valenza.
I periodi sono 7 e sono indicati con i numeri arabi mentre i gruppi sono indicati con i numeri romani e la lettera A o B.
La tavola periodica è suddivisa in quattro blocchi corrispondenti ai tipi di orbitali:
- blocco s: corrisponde ai gruppi IA e IIA. Gli elementi hanno l’ultimo elettrone in un orbitale s;
- blocco p: corrisponde ai gruppo IIIA-0. Gli elementi hanno l’ultimo elettrone in un orbitale p;
- blocco d: gruppi B. Gli elementi hanno l’ultimo elettrone in un orbitale d;
- blocco f: gli elementi hanno l’ultimo elettrone nell’orbitale f.

Proprietà periodiche degli elementi
In base alla posizione che un elemento occupa nella tavola periodica, siamo in grado di ottenere informazioni relative alle proprietà fisiche e chimiche dell’elemento stesso.
Dimensione atomica
La dimensione atomica dipende dalla disposizione degli elettroni che risentono dell’attrazione del nucleo. Come abbiamo visto, secondo il modello ondulatorio, non possiamo definire un limite alla nube elettronica che circonda il nucleo, e quindi il confine dell’atomo. Nonostante ciò possiamo approssimare questa distribuzione ad una sfera e calcolare il raggio atomico come una misura della semidistanza di nuclei di atomi adiacenti in una molecola biatomica.
Il raggio atomico aumenta lungo i gruppi procedendo dall’alto verso il basso in quanto man mano che si scende nel gruppo aumenta il numero quantico n e quindi l’orbitale in corso di riempimento è più distante dal nucleo.
Il raggio atomico diminuisce lungo i periodi procedendo da sinistra a destra in quanto aumenta il numero dei protoni e quindi l’attrazione del nucleo nei confronti degli orbitali di valenza.
Energia di ionizzazione
L’energia di ionizzazione è l’energia necessaria per sottrarre un elettrone ad un atomo, dando origine ad un catione (es. l’energia necessaria a sottrarre un e– al sodio Na mi permette di ottenere il catione corrispondente, ossia Na+).
Parliamo di energia di prima ionizzazione quando si sottrae l’elettrone più esterno ad un elemento neutro; parliamo, invece, di energia di seconda ionizzazione quando si sottrae l’elettrone più esterno ad un catione con carica +1.
L’andamento dell’energia di ionizzazione è opposto rispetto a quello della dimensione atomica: diminuisce nei gruppi dall’alto verso il basso e diminuisce nei periodi da destra verso sinistra. Più lontani sono gli elettroni dal nucleo, meno energia di ionizzazione deve essere utilizzata per sottrarre l’elettrone più esterno.
Affinità elettronica
L’affinità elettronica è l’energia liberata da un atomo quando questo acquista un elettrone diventando anione. L’elettrone conferisce una carica negativa all’atomo. (Es. il Cl che acquista un elettrone diventa ione negativo Cl–). L’andamento è uguale a quello dell’energia di ionizzazione, diminuisce nei gruppi dall’alto verso il basso e diminuisce nei periodi da destra verso sinistra.
Elettronegatività
L’elettronegatività è la tendenza di un atomo ad attrarre gli elettroni di legame. Aumenta lungo i periodi e diminuisce lungo i gruppi. L’elettronegatività è una grandezza adimensionale che per convenzione viene indicata con una scala che va da 0 a 4. Il fluoro è l’elemento più elettronegativo (elettronegatività pari a 4) mentre il cesio è quello meno elettronegativo (0,7). Secondo questo metodo non è possibile calcolare l’elettronegatività dei gas nobili, che assumiamo pari a 0.

Classificazione degli elementi
Gli elementi della tavola periodica possono essere suddivisi in tre gruppi principali: metalli, semimetalli e non-metalli.
I metalli hanno pochi elettroni nel guscio di valenza, hanno bassa energia di ionizzazione, bassa affinità elettronica, bassa elettronegatività e tendono a formare cationi. Sono gli elementi più abbondanti e sono generalmente solidi. Grazie alle loro proprietà sono dei buoni conduttori di corrente e di calore, sono lucenti e malleabili.
I non-metalli hanno alta energia di ionizzazione, alta affinità elettronica e alta elettronegatività e formano facilmente anioni. Non sono conduttori termici ed elettrici, non sono lucenti né malleabili.
I semimetalli hanno caratteristiche intermedie tra metalli e non-metalli. Si comportano in maniera diversa a seconda dell’atomo con cui si legano. Sono capaci di condurre la corrente elettrica solo in particolari condizioni ed è per questo che sono definiti semiconduttori.
L’immagine che segue rappresenta tutti gli elementi della tavola periodica e le loro proprietà:

L’ultimo gruppo all’estrema destra è rappresentato dai gas nobili che sono costituiti da atomi con i gusci elettronici completi. Generalmente non sono reattivi e si trovano a varie percentuali nell’atmosfera. Nel gruppo VII A troviamo gli alogeni.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Configurazione elettronica
La configurazione elettronica indica la distribuzione degli elettroni nei vari orbitali. Essa viene rappresentata graficamente come visto nella scheda precedente, indicando gli elettroni con delle frecce. Sempre come visto nella scheda precedente, la notazione degli orbitali è rappresentata dal livello energetico seguito dal sottolivello. Esempio: 1s indica il livello energetico 1 dell’ orbitale s. In questa notazione il numero totale di elettroni viene posto come esponente del sottolivello, quindi riprendendo l’esempio precedente scriveremo 1s2 che significa che due elettroni sono presenti nell’orbitale s del primo livello energetico.
L’ordine di riempimento dei vari orbitali segue tre principi fondamentali:
- principio di Aufbau;
- principio di esclusione di Pauli;
- principio della massima molteplicità (regola di Hund).
- Gli orbitali vengono riempiti seguendo l’ordine dato dalla regola della diagonale (come spiegato nella scheda precedente).
- In ogni orbitale possono coesistere al massimo due elettroni di spin opposto (antiparalleli).
- Quando sono presenti più orbitali di pari energia (degeneri), gli elettroni si dispongono singolarmente, con spin paralleli, sul numero massimo di questi. Gli orbitali risulteranno semioccupati e gli elettroni saranno abbastanza lontani da limitare la repulsione elettronica.
Procediamo portando ad esempio la configurazione elettronica di alcuni elementi, applicando le regole di distribuzione elettronica.
- Idrogeno
L’idrogeno è l’elemento più semplice presente in natura. Possiede un solo elettrone che si trova nell’orbitale s a più bassa energia. La sua configurazione elettronica è 1s1.
- Litio
Il litio ha tre elettroni: due si sistemano nell’orbitale 1s mentre il terzo elettrone si sistema nell’orbitale a più bassa energia del secondo livello energetico. La configurazione elettronica è 1s22s1.
- Carbonio
Il carbonio ha sei elettroni: due si sistemano nell’orbitale 1s, altri due si sistemano nell’orbitale 2s, uno nell’orbitale 2px e l’ultimo nell’orbitale 2py (secondo la regola di Hund). La configurazione elettronica è 1s22s22p2.
- Ossigeno
L’ossigeno ha otto elettroni che occuperanno l’orbitale 1s, l’orbitale 2s e gli orbitali 2p.La configurazione elettronica è 1s22s22p4.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Gli orbitali
Gli orbitali di un atomo aventi lo stesso numero quantico principale n appartengono allo stesso strato o stesso livello energetico:
- lo strato n = 1 viene chiamato anche strato K;
- lo strato n = 2 viene chiamato anche strato L;
- lo strato n = 3 viene chiamato anche strato M.
Gli orbitali con lo stesso numero quantico secondario l appartengono allo stesso sottostrato o sottolivello:
- gli orbitali con l = 0 vengono chiamati orbitali s ;
- gli orbitali con l = 1 vengono chiamati orbitali p;
- gli orbitali con l = 2 vengono chiamati orbitali d ;
- gli orbitali con l = 3 vengono chiamati orbitali f .
Gli orbitali appartenenti allo stesso sottolivello sono definiti degeneri.
Nel primo livello di energia n = 1, l può assumere solo ed esclusivamente il valore 0. Questo significa che avremo un solo tipo di orbitale, ossia l’orbitale s (indicato come 1s), di forma sferica. Questo livello può ospitare solo due elettroni.
Nel secondo livello di energia n = 2, l può assumere i valori 0 e 1. Quindi, i possibili tipi di orbitali sono s e p. In particolare, troviamo l’orbitale 2s e, ad un livello energetico leggermente superiore, troviamo i tre orbitali 2p, contraddistinti dai valori che assume m (il numero quantico magnetico che indica l’orientazione di un orbitale): -1, 0, +1. In questo livello possono stare otto elettroni.
Nel terzo livello di energia n = 3, l può assumere i valori 0, 1 e 2. Avremo quindi gli orbitali s, p e d. Oltre all’orbitale 3s e ai tre orbitali 3p, ad energia leggermente più elevata avremo i cinque orbitali d le cui orientazioni sono date dai seguenti valori di m: -2, -1, 0, +1, +2. Questo livello energetico può ospitare 18 elettroni.
Nel quarto livello di energia n = 4, l assume i valori 0, 1, 2 e 3 e quindi avremo orbitali s, p, d ed f. In particolare avremo l’orbitale 4s, i tre orbitali 4p, i cinque orbitali 4d e i sette orbitali 4f, questi ultimi con valori di m pari a -3, -2, -1, 0, +1, +2, +3. Questo livello può ospitare 32 elettroni.

Nonostante nell’ambito dello stesso livello energetico i sottolivelli abbiano energia crescente, non sempre un orbitale di un dato livello ha una energia più bassa di tutti gli orbitali del livello superiore. L’energia di un orbitale dipende in prima istanza dal numero quantico principale n e, a parità di n, l’energia degli orbitali aumenta all’aumentare di l. L’ordine di energia crescente sarà dunque: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p..

(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Il modello atomico di Bohr
Il modello atomico successivo a quello di Rutherford è il modello proposto da Bohr il quale, basandosi sul modello di Rutherford stesso e sulla teoria quantistica di Max Planck, ipotizza l’esistenza di orbite stazionarie nelle quali gli elettroni si muovono senza emettere energia.
Vediamo, in breve, quali sono le basi su cui Bohr costruisce il proprio modello atomico.
SPETTRI CONTINUI E A RIGHE
In quel periodo molti fisici stavano studiando i due diversi tipi di spettri, quelli continui e quelli a righe.
Un fascio di luce emesso da una sorgente luminosa, se attraversa un prisma trasparente, viene scomposto nelle radiazioni che lo costituiscono che sono deviate con un angolo che dipende dalla loro frequenza. Ad esempio, la luce bianca è policromatica, ossia costituita da radiazioni a diversa frequenza che formano uno spettro continuo.
Anche gli elementi in fase gassosa, se eccitati o riscaldati, emettono luce. In questi casi, scomponendo la luce emessa con un prisma si osserva un numero ridotto di frequenze che sono caratteristiche dell’elemento considerato (spettro discontinuo).
MAX PLANCK E I QUANTI
La teoria quantistica di Planck si fonda sullo studio dello spettro dei corpi neri. Se noi consideriamo un corpo, che sia un solido o un gas compresso, e lo riscaldiamo, osserviamo un cambiamento di colore del corpo in esame che dipende dalla temperatura. Si definisce corpo nero un corpo che assorbe tutta la radiazione incidente senza rifletterla. Questo significa che tutta la radiazione che viene emessa da un corpo nero è dovuta alla sua temperatura.
Lo spettro di un corpo nero ha una forma a campana e dipende esclusivamente dalla sua temperatura; all’aumentare della temperatura avrò una emissione di radiazioni ad energia maggiore. Tuttavia, secondo la teoria classica dell’epoca, un corpo nero sufficientemente caldo dovrebbe emettere radiazioni elettromagnetiche a intensità infinita. Questo paradosso fu definito ‘catastrofe ultravioletta’.
La spiegazione arrivò da Planck il quale afferma che l’energia che viene emessa dai corpi è discreta, viene emessa sotto forma di quantità di pacchetti chiamati quanti, e assume valori legati alla frequenza della radiazione secondo la seguente equazione:
E = hv
dove h = 6,626 ∙ 10-34 J ∙ s è la costante di Planck
MODELLO DI BOHR
Bohr, partendo dallo studio degli spettri, basandosi sul modello di Rutherford e sulle scoperte di Planck, propone il proprio modello secondo cui:
- gli elettroni si muovono intorno al nucleo su orbite fisse e quantizzate (ossia dotate di energia predefinita);
- gli elettroni non emettono né assorbono energia;
- l’atomo può scambiare energia con l’esterno solo se un suo elettrone passa da un’orbita stazionaria ad un’altra. L’elettrone che acquisisce energia salta su un’orbita a maggiore energia. Questo elettrone però è instabile e quindi deve tornare nell’orbita dove si trovava prima, a più bassa energia e quindi salta ad un livello energetico inferiore. Questo salto prevede l’emissione di un fotone di energia pari alla differenza di energia tra le due orbite.

Dunque, gli scambi di energia tra un atomo e l’ambiente che lo circonda avvengono per assorbimento o emissione di un fotone con energia pari a hv . Il modello di Bohr è esemplificato nella seguente immagine:

Questo modello verrà successivamente messo in discussione dall’avvento di due importanti scoperte:
- gli elettroni, come la luce, hanno una natura ondulatoria-particellare. Quindi era possibile associare alla massa dell’elettrone una lunghezza d’onda (De Broglie);
- è impossibile conoscere simultaneamente la posizione e la velocità dell’elettrone (principio di indeterminazione di Heisenberg) poiché se io volessi individuare la posizione di un elettrone dovrei illuminarlo con un fotone, che rappresenta energia. Questo fotone verrebbe acquisito come uno stimolo eccitatorio che farebbe deviare l’elettrone dalla traiettoria in cui si trova.
Pertanto si arriva a comprendere che non è possibile rappresentare un elettrone come una palla che ruota lungo un’orbita.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Principio di indeterminazione di Heisenberg
Il fisico tedesco Heisenberg studiò il modello atomico di Bohr riscontrando dei limiti soprattutto riguardanti il concetto di orbita. Bohr affermava che gli elettroni si muovessero attorno al nucleo su delle orbite, presupponendo di conoscere contemporaneamente la posizione e la velocità degli elettroni in ogni istante del loro moto. Se volessimo determinare la posizione di un elettrone dovremmo irradiare con dei fotoni che interagirebbero con l’elettrone deviandone la traiettoria e modificandone la velocità. Heisenberg dimostrò che era impossibile determinare con precisione arbitraria la posizione e la velocità di un elettrone contemporaneamente.
Nello stesso periodo il fisico Scrhödinger, attraverso la sua equazione d’onda, descrive la natura dualistica degli elettroni.
Con i due scienziati sopracitati si afferma il modello quantistico, caratterizzato dalla descrizione probabilistica dell’atomo.
PRINCIPIO DI INDETERMINAZIONE DI HEISENBERG
Il principio di indeterminazione di Heisenberg afferma che non è possibile determinare con precisione arbitraria e contemporaneamente due variabili coniugate, ossia non è possibile conoscere con esattezza e contemporaneamente due variabili quali posizione e quantità di moto di una particella.
Questo vuol dire che se misuriamo la posizione e la velocità di una particella, le grandezze che otteniamo sono caratterizzate da errori di misura il cui prodotto sarà sempre maggiore o uguale a ħ/2 (dove ħ rappresenta la costante di Planck ridotta).
Una conseguenza di tale principio è che per gli elettroni non si può parlare di traiettorie ma di spazi in cui la probabilità di trovare un elettrone è diversa da zero.
L’EQUAZIONE DI SCHRÖDINGER
L’equazione di Schrödinger descrive la natura dualistica onda/particella degli elettroni. Le soluzioni che descrivono gli elettroni forniscono delle informazioni probabilistiche circa la posizione di un elettrone all’interno dell’atomo. Se, attraverso un esperimento, volessimo definire la posizione di una particella, troveremmo qualcosa e quel qualcosa sarebbe di natura una particella. Se questo non accade, allora parliamo di una distribuzione di probabilità che fornisce una informazione riguardo la posizione probabile di un elettrone.
Schrödinger introduce la funzione d’onda e afferma che il modulo al quadrato della funzione d’onda è pari alla probabilità di trovare un elettrone in un punto preciso dello spazio. Egli, inoltre, definisce orbitali le regioni a maggior probabilità di trovare gli elettroni.
All’interno dell’atomo esistono regioni che hanno una certa probabilità che ci sia l’elettrone.
Gli orbitali sono delle vere e proprie strutture tridimensionali di probabilità, non sono delle regioni in cui l’elettrone si muove ma sono delle regioni in cui è massima la probabilità di trovare un elettrone. L’orientamento, la forma e la dimensione degli orbitali è definita dai numeri quantici.
Numeri quantici:
- ogni orbitale è univocamente determinato dai tre numeri quantici n, m, l;
- ogni orbitale può ospitare al massimo due elettroni che differiscono per il quarto parametro quantico ms;
- orbitali che ospitano elettroni di pari energia si definiscono isoenergetici;
- lo stato di un elettrone in un atomo è univocamente determinato dai quattro numeri quantici n, m, l, ms.
Il numero quantico n è il principale e indica la dimensione, il livello energetico dell’orbitale e può assumere valori quali 1,2,3.. Il numero quantico l è il numero quantico secondario (o angolare) e indica la forma dell’orbitale, il momento angolare dell’elettrone, e può essere compreso tra 0 e n-1. Il numero quantico m è quello magnetico e indica l’orientamento dell’orbitale nello spazio; può assumere valori quali 0, ±1,…, ± l. Infine, il numero quantico ms è il numero di spin, indica il senso di rotazione dell’elettrone intorno al proprio asse e può assumere i valori +1/2 e -1/2.
Riassunto dell’evoluzione dei modelli atomici

(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
La teoria atomica di Dalton
1.1 TEORIA ATOMICA DI DALTON
Il concetto di atomo è un concetto molto antico che risale al 400 a.C. quando Democrito formulò le prime idee fondamentali sulla teoria atomica. Dalton riprese le idee di Democrito, conferendogli valore scientifico.
La teoria atomica di Dalton si aggancia a due leggi fondamentali che sono state formulate da Lavoisier e Proust, rispettivamematernte nel 1783 e nel 1799.
Legge della conservazione della massa di Lavoisier: Lavoisier, studiando i fenomeni chimici, concluse che in natura, come nei processi artificiali, nulla si crea né si distrugge, e quindi la quantità di materia di partenza è uguale alla quantità di materia finale. Ossia, in una reazione chimica, la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.
Esempio: consideriamo la reazione di combustione del legno che produce cenere. Di primo acchito potremmo pensare che la quantità di legno di partenza che abbiamo utilizzato è diversa dalla quantità di cenere che abbiamo ottenuto. Nella realtà, la quantità di legno di partenza e dell’aria consumata è uguale alla somma delle masse delle ceneri, del fumo e di tutti gli altri prodotti della combustione.
Legge delle proporzioni definite o della costanza della composizione di Proust: quando due o più elementi formano un composto le quantità che reagiscono sono in rapporto definito e costante.
La legge delle proporzioni definite spiega come il rapporto di combinazione dei reagenti rimane invariato.
Esempio: l’acqua è composta dall’ 88,8% di ossigeno e dall’ 11,2% di idrogeno. Questo significa che ho bisogno di 88,8 g di ossigeno e 11,2 g di idrogeno per ottenere 100 g di acqua. Supponiamo di far reagire, invece che 11,2 g di idrogeno, 15 g di idrogeno con 88,8 g di ossigeno. Dalla reazione otterremo sempre 100 g di acqua, con la differenza che 3,8 g di idrogeno non hanno reagito e sono rimasti in eccesso.
A partire da queste leggi, Dalton formulò la teoria atomica:
- tutti gli elementi sono costituiti da particelle piccolissime che sono gli atomi;
- tutti gli atomi di un elemento sono uguali ed hanno uguale massa, mentre atomi di elementi diversi hanno massa diversa;
- nelle reazioni chimiche gli atomi conservano la propria identità, ossia conservano le proprie caratteristiche. Gli atomi si uniscono e si dividono, ma non vengono né creati, né distrutti, né vengono convertiti in atomi diversi (questo conferma la legge della conservazione della massa);
- gli atomi di elementi diversi si combinano a formare composti. In un composto gli atomi si uniscono in rapporti costanti (questo conferma la legge delle proporzioni definite: se il rapporto tra gli atomi di un composto è fisso, lo sarà anche il rapporto delle rispettive masse).
1.2 LA LEGGE DELLE PROPORZIONI MULTIPLE DI DALTON
La legge delle proporzioni multiple nasce dall’osservazione, da parte di Dalton, del fatto che due elementi possono combinarsi a dare più composti stando tra loro in rapporti facilmente esprimibili. Ossia, quando due elementi si combinano tra loro per dare due o più composti, le quantità in peso di uno che si combinano con una quantità fissa dell’altro, stanno tra loro in rapporti semplici esprimibili mediante numeri interi piccoli. Questa legge è strettamente correlata al punto 3 sopracitato della teoria atomica di Dalton, secondo cui gli atomi si combinano in rapporti diversi mantenendo la propria identità.
Procediamo con alcuni esempi:
Consideriamo i due composti metano e propino che sono costituiti da carbonio e idrogeno, ma in proporzioni differenti.

Per ottenere 100 g di propino abbiamo bisogno di 90 g di carbonio e 10 g di idrogeno. Per ottenere 100 g di metano abbiamo invece bisogno di 74,87 g di carbonio e 25,13 g di idrogeno. La composizione percentuale di questi due composti è differente.
Se volessimo produrre metano a partire da 10 g di idrogeno, quanto carbonio dovremmo utilizzare? Con una semplice proporzione otteniamo:
25,13 : 74,87 = 10 : x
x = 29,79 g di carbonio per produrre metano
Pertanto la stessa quantità di idrogeno (10 g) richiede 90 g di carbonio per produrre il propino e 29,79 g di carbonio per produrre metano. Facendo il rapporto tra le due masse (29,79/90) osserviamo che il rapporto è di 1 : 3, ossia la quantità di carbonio necessaria per produrre il propino è circa tre volte tanto la quantità di carbonio necessaria per produrre metano; a conferma di ciò, gli atomi di carbonio contenuti nella molecola di propino sono il triplo di quelli contenuti nel metano.
La stessa cosa vale per l’anidride carbonica e il monossido di carbonio. Questi due composti sono costituiti da carbonio e ossigeno ma in proporzioni diverse. Il numero degli atomi di carbonio presente nell’anidride carbonica (CO2) è il doppio del numero di atomi di carbonio presente nel monossido di carbonio (CO).
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Il modello atomico di Thompson e di Rutherford
MODELLO ATOMICO DI THOMSON
Joseph John Thomson è stato un fisico britannico che nel 1896 dimostrò, attraverso una serie di esperimenti, che i raggi catodici erano costituiti da piccole particelle cariche negativamente che egli chiamava ‘corpuscoli’. Thomson ne definì la massa e la carica e solo successivamente questi ‘corpuscoli’ furono chiamati elettroni.
Subito dopo la scoperta dell’elettrone, Thomson, nel 1904, propose un modello atomico che fu definito modello a panettone in cui l’atomo veniva rappresentato come una distribuzione di carica positiva diffusa, contenente delle cariche negative disposte in maniera regolare, in anelli rotanti. Se consideriamo un panettone, i canditi rappresentano gli elettroni immersi in una pasta carica positivamente.

Questo modello propone quindi che le cariche negative siano in grado di neutralizzare la presenza delle cariche positive in cui sono immerse, stabilendo che l’atomo è neutro.
Thomson, così, rappresenta l’atomo non più come qualcosa di indivisibile, ma piuttosto come qualcosa di divisibile, in quanto costituito da particelle subatomiche, più piccole dell’atomo stesso.
MODELLO ATOMICO DI RUTHERFORD
Ernest Rutherford, chimico e fisico britannico, fece un esperimento che culminò con la confutazione del modello atomico a panettone proposto da Thomson. Egli dimostrò che l’atomo era costituito da un nucleo centrale in cui si concentrava la maggior parte della materia carica positivamente (nucleo atomico), intorno al quale ruotavano gli elettroni. Quindi, a differenza del modello atomico di Thomson in cui l’atomo è rappresentato come una sfera carica positivamente, in cui sono immersi gli elettroni, il modello atomico planetario di Rutherford propone un atomo ‘vuoto’ che concentra tutta la materia carica positivamente in un nucleo delimitato, attorno al quale ruotano gli elettroni.

ESPERIMENTO DI RUTHERFORD
L’esperimento di Rutherford aveva come scopo quello di confermare il modello atomico proposto da Thomson.
Questo esperimento prevedeva l’utilizzo di una sorgente radioattiva in grado di emettere particelle alfa che venivano sparate su una lamina d’oro.
Quello che ci si aspettava era che le particelle alfa, una volta entrate in contatto con la lamina d’oro, la attraversassero parallelamente o al più venissero leggermente deviate tutte allo stesso modo, data l’omogeneità dell’atomo. Quello che si osservò, invece, era che alcune particelle venivano deviate anche con angoli maggiori di 90°, tornando verso la fonte che le aveva generate.
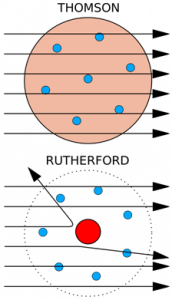
L’ipotesi di Rutherford fu che l’atomo doveva essere costituito da una zona centrale di materia estremamente densa nonché carica, in grado di interrompere il decorso delle grandi particelle alfa, e addirittura in grado di farle rimbalzare.
Grazie a questo esperimento Rutherford è giunto alla conclusione che al centro dell’atomo vi fosse un nucleo denso e carico positivamente, che intorno ad esso ruotassero elettroni carichi negativamente in numero tale da neutralizzare la carica positiva e che tra il nucleo e gli elettroni ci fosse spazio vuoto.
Questo modello non fu accettato completamente dalla comunità scientifica in quanto entrava in contrasto con la fisica classica secondo cui una particella carica accelerata emette energia sotto forma di radiazione elettromagnetica, perdendo energia. Gli elettroni che ruotano attorno al nucleo centrale perderebbero energia fino ad annichilire, ossia a collassare sul nucleo.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
-
Postato in Chimica
Metodi di separazione
Esistono metodi fisici di separazione che permettono di ottenere le singole fasi di una miscela. La scelta del metodo da utilizzare si basa sulle caratteristiche fisiche e chimiche della miscela stessa.
- Distillazione: metodo che sfrutta i diversi punti di ebollizione dei componenti di una miscela. Distinguiamo la distillazione semplice dalla distillazione frazionata.
La distillazione semplice è in grado di separare una componente liquida da una miscela liquido-solida. Tramite questo metodo si può separare, ad esempio, l’acqua marina in acqua e sale. La distillazione semplice può anche essere utilizzata per separare una componente liquida da una miscela omogenea liquido-liquido, purché i punti di ebollizione di ciascun componente siano distanti.
La distillazione frazionata viene utilizzata invece per separare una componente liquida da una miscela omogenea liquido-liquido, in cui le varie componenti presentano punti di ebollizione vicini tra loro.
- Filtrazione: metodo che sfrutta la diversa dimensione delle particelle di una miscela eterogenea solido-liquido. Si utilizza la carta da filtro che presenta dei piccoli pori che permettono solo il passaggio della componente liquida.
- Cromatografia: metodo che permette di separare i componenti di una miscela in base alle caratteristiche chimico-fisiche: massa molecolare, carica e solubilità. I principi su cui si basa la cromatografia sono caratterizzati dalla presenza di una fase stazionaria e di una fase mobile che possono essere diverse, ma che sono presenti in tutti i tipi di cromatografia. La fase stazionaria è generalmente immobile mentre la fase mobile è quella che scorre attraverso o al di fuori della fase stazionaria. Il metodo sfrutta la diversa affinità delle componenti di una miscela verso le due fasi opportunamente scelte e sistemate in una colonna detta colonna cromatografica.
- Centrifugazione: metodo che permette di separare le varie componenti di una miscela sulla base delle loro diverse densità. Le componenti più dense saranno più lontane dall’asse di rotazione rispetto alle componenti meno dense. La centrifuga prevede l’utilizzo di un rotore che può essere a braccio oscillante o ad angolo fisso sottoposto a forza centrifuga. Nel caso del rotore a braccio oscillante i contenitori vengono agganciati in posizione verticale. Quando il rotore inizia a ruotare, il contenitore è soggetto a forza centrifuga e si mette in posizione orizzontale. Le particelle sospese vengono spinte verso il fondo della provetta.
Nel caso del rotore ad angolo fisso gli alloggiamenti sono posti circolarmente attorno all’asse di rotazione ad un angolo prefissato. Le particelle sono spinte verso l’esterno, sulla parete della provetta e non sul fondo.
Come nella cromatografia, esistono diversi tipi di centrifugazione.
- Estrazione con solventi: metodo utilizzato per separare due liquidi immiscibili sfruttando la loro diversa solubilità. Il metodo prevede l’utilizzo di un solvente che sia selettivo per una delle due fasi, ossia che sia in grado di sciogliere in esso soltanto il liquido di interesse.
- Sedimentazione: metodo che permette di separare un solido da un liquido lasciando la miscela a riposo e permettendo al solido di depositarsi. Questo metodo funziona se la densità del liquido è molto diversa dalla densità del solido sospeso.
(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
La composizione della materia
MISCELE E SOSTANZE PURE
Per definizione l’atomo è l’unità microanatomica della materia che conserva le caratteristiche chimiche dell’elemento. Gli atomi sono tuttavia divisibili in quanto costituite da particelle subatomiche: protoni, neutroni ed elettroni.
La materia può manifestarsi sotto forma di miscele (o miscugli) oppure sostanze (o sostanze pure).
Le miscele possono essere eterogenee o omogenee:
- le miscele eterogenee sono composte da due o più fasi immiscibili tra di loro. Un esempio di miscela eterogenea è quella di acqua e olio: mischiando queste due sostanze si può apprezzare il fenomeno definito emulsione (vedi capitolo Soluzioni) in cui le varie componenti sono distinguibili;
- le miscele omogenee sono composte da un’unica fase uniforme e le varie componenti non sono distinguibili. Le miscele omogenee sono anche chiamate soluzioni.
È importante notare che i componenti di una miscela mantengono alcune delle loro proprietà inalterate e spesso una miscela presenta delle caratteristiche intermedie a quelle dei vari componenti.
Una sostanza pura è una frazione della materia dalle caratteristiche ben definite. Tante sostanze diverse possono combinarsi tra loro a costituire la materia. Nella realtà una sostanza non è mai perfettamente pura ma è costituita in minima parte anche da altre sostanze perché è tecnicamente difficile isolare un’unica sostanza/fase e non è reperibile naturalmente.
In base alla possibilità di scindere o meno una sostanza, distinguiamo:
- elementi: sono sostanze costituite da atomi dello stesso tipo e non possono essere scomposte in parti più semplici.
- composti: combinazioni di uno o più elementi, legati tra di loro a formare reticoli cristallini, come il cloruro di sodio (NaCl) e il cloruro di potassio (KCl), o molecole come l’acqua (H2O) e l’anidride carbonica (CO2). I composti possono essere scomposti in una o più sostanze semplici (elementi).

Schema riassuntivo:

(Le immagini sono tratte da Wikipedia)
Potrebbero interessarti
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [4] – Legame covalente polare e dativo
- Legami chimici [5] – Legame ionico
- Postato in Chimica
