Come sappiamo, il calore è in grado di passare da un corpo più caldo ad uno più freddo; proprio per questo si parla di passaggio di calore. In questo modo, quindi, è possibile scaldare un qualsiasi oggetto.
Tuttavia, questo non è l’unico modo per trasferire calore; infatti, si può trasferire calore ad un corpo anche mediante una forza che compie un lavoro. Questo spiega, ad esempio, come mai è possibile accendere un fuoco con il semplice sfregamento di due bastoncini di legno.
Per la prima volta nel 1800, Joule ideò un esperimento che permise di capire quanto lavoro è necessario per aumentare di aumentare la temperatura di una certa quantità d’acqua.
Il suo esperimento si basava proprio sul fatto che il lavoro compiuto dalla forza-peso su dei pesetti provocasse il movimento di alcune eliche presenti all’interno di un recipiente isolato termicamente. Il movimento delle eliche nell’acqua provocava un aumento della temperatura del liquido.
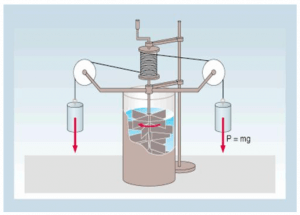
Conoscendo la quantità d’acqua presente, e la massa dei pesetti, Joule concluse che per aumentare la temperatura di 1 kg di acqua di 1 K è necessario un lavoro di 4186 J.
Il calore e il lavoro, quindi, sono delle grandezze che, per alcuni aspetti, possono essere considerate simili. In particolare, si può notare che sia compiendo un lavoro, sia trasferendo del calore, si ha un passaggio di energia da un sistema ad un altro.
Ad esempio, un forte getto di vapore ad alta pressione è in grado di far ruotare una turbina che, nelle centrali idroelettriche, permette di generare energia elettrica.
Proprio per questo, il calore viene misurato, nel Sistema Internazionale, in Joule, in quanto a questa grandezza si associa un trasferimento di energia.
Una unità di misura alternativa del calore, che non fa parte però del Sistema Internazionale, è la caloria; una caloria corrisponde alla quantità di energia necessaria per far aumentare di 1°C la temperatura di 1g di acqua distillata, portando la sua temperatura da 14,5°C a 15,5°C.
Quando riscaldiamo un corpo, quindi, o compiendo un lavoro su di esso, o trasferendogli del calore tramite un corpo più caldo, stiamo aumentando la sua energia interna. Ciò è vero per la conservazione dell’energia; come sappiamo, l’energia non si crea e non si distrugge, ma si trasforma in altre forme di energia.
La capacità termica
Non tutti i corpi hanno la stessa capacità di assorbire il calore; per questo, una stessa quantità di calore può avere effetti differenti su due corpi diversi.
Per valutare gli effetti del calore sui corpi è necessario considerare la loro capacità termica C; questa viene espressa come rapporto dell’energia assorbita dal corpo sulla differenza di temperatura che esso subisce:
$ C = frac(∆E)(∆T)$
Possiamo affermare che la capacità termica di un corpo è numericamente uguale alla quantità di energia che dobbiamo fornire ad un corpo per far aumentare la sua temperature di 1K.
Il calore specifico
La capacità termica di un corpo dipende dalle caratteristiche del corpo stesso, e in particolare aumenta all’aumentare della sua massa. Infatti, la capacità termica è descritta dalla legge:
$ C = c * m$
Nella formula c indica il calore specifico della sostanza.
Il calore specifico di una sostanza, quindi, è numericamente uguale alla quantità di energia che dobbiamo fornire per aumentare la temperatura di una sostanza di 1 kg di 1 K.
Dalle relazione che abbiamo fornito in precedenza, possiamo ricavare una legge che permette di determinare l’energia che viene scambiata quando vi è un aumento di temperatura in un corpo di massa m.
Infatti, abbiamo le seguenti relazioni:
$ C = frac(∆E)(∆T) to ∆E = C * ∆T , C = c * m $
Da cui otteniamo:
$∆E = C * ∆T = c * m * ∆T $
La formula precedente è valida sia nel caso in cui si ha una variazione di temperatura dovuta ad un lavoro che viene effettuato, sia quando tale variazione è dovuta ad uno scambio di calore; in quest’ultimo caso, la legge può anche essere scritta nel modo seguente:
$ Q = c * m * ∆T $
Dove Q indica, appunto, il calore che viene scambiato.
Potrebbero interessarti
Appunti: Il calorimetro
Appunti: Il potere calorifico
