La corrente elettrica può circolare, oltre che nei solidi come i metalli, anche nei liquidi, con alcune eccezioni.
Quando si studiano le soluzioni che possono permettere il passaggio di corrente, si utilizza un apparato che prende il nome di cella elettrolitica: esso è costituito da due elettrodi, ossia conduttori metallici collegati ai poli di un generatore, che vengono immersi nella soluzione che si vuole studiare.
Le soluzioni elettrolitiche
Come accennato in precedenza, non tutte le soluzioni sono in grado di condurre corrente elettrica.
Ad esempio, se consideriamo una soluzione di acqua distillata, e vi immergiamo due elettrodi connessi ad una pila, non vi sarà passaggio di corrente; la stessa cosa avviene per una soluzione di acqua e zucchero. In questi casi, si parla di soluzioni non elettrolitiche.
La situazione cambia quando si sciolgono in acqua dei sali, delle basi, o degli acidi; queste sostanze, infatti, quando si trovano in acqua liberano ioni positivi o negativi, che possono muoversi all’interno del liquido, e vengono attratti dagli elettrodi posti in esso. Gli elettroni che si muovono nella soluzione, quindi, completano il circuito, e permettono alla corrente di circolare.
In questo caso si parla di soluzioni elettrolitiche, e le sostanze che disciolte nell’acqua per mettono il passaggio di corrente vengono definiti elettroliti.
Le soluzioni elettrolitiche soddisfano la prima legge di Ohm, se la temperatura della soluzione non raggiunge valori troppo elevati.
Vediamo ora in dettaglio come mai alcune sostanze, disciolte in acqua, sono in grado di rendere l’acqua un buon conduttore di corrente.
Un sale disciolto in acqua
Analizziamo, ad esempio, il caso in cui la sostanza elettrolita sia un sale; consideriamo il caso più semplice, quello del sale da cucina, ovvero il cloruro di sodio (NaCl).
Gli atomi di questo sale sono legati tra loro, formando molecole, con un particolare tipo di legame, che si definisce legame ionico.
Il nome del legame viene dal fatto che il sale presenta una struttura cristallina molto regolare, formata dall’aggregazione di ioni; sono positivi quelli del sodio e negativi quelli del cloro.
Questi ioni si formano perché vi è il trasferimento di un elettrone dal sodio al cloro (più elettronegativo), in modo che entrambi raggiungano la configurazione stabile dell’ottetto (ultimo orbitale pieno).
La struttura cristallina di per se è moto stabile, tuttavia, l’acqua è in grado di rompere i reticoli formati dalle molecole, e sciogliere così il sale.
Le molecole di acqua, infatti, sono molecole polari, cioè in esse la carica non è distribuita in maniera uniforme, ma è concentrata in maniera differente sugli atomi che le costituiscono, dando luogo a dei dipoli; si avrà, quindi, una parziale carica negativa sugli atomi di ossigeno, e una parziale carica positiva su quelli di idrogeno.
Quando il sale si trova in acqua, le molecole di acqua tendono a schermare la carica elettrica degli ioni.
Gli ioni positivi di sodio vengono circondati dalle molecole di acqua polarizzate, in modo da svolgere verso Na+ la parte negativa, cioè l’atomo di ossigeno; gli ioni di cloro, invece, vengono circondati dalle molecole polarizzate di acqua che rivolgono a Cl- la parte positiva, quella dell’idrogeno.
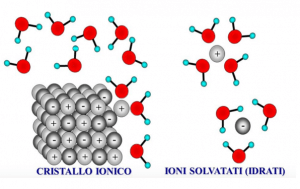
In seguito allo sfaldamento delle molecole di sale, all’interno della soluzione rimangono semplicemente gli ioni Na+ e Cl-, che sono liberi di muoversi all’interno di essa.
La dissociazione elettrolitica
Quando, poi, nella soluzione sono immersi degli elettrodi (quello positivo si definisce anodo, quello negativo catodo), e si genera corrente, gli ioni sono attratti verso i poli; si crea, così, un moto di cariche elettriche nella soluzione.
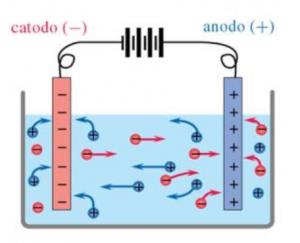
Questo fa si che la corrente continui a circolare all’interno del liquido, chiudendo così il circuito generato dalla cella elettrolitica.
La dissociazione di sostanze in acqua, come avviene nel caso del cloruro di sodio, prende i nome di dissociazione elettrolitica.
Potrebbero interessarti
Video Lezioni: Elettromagnetismo
Vide Lezioni: Onde e Luce
Appunti: L’elettrolisi e le leggi di Faraday
Appunti: I raggi catodici
Appunti: Le pile
Appunti: Gli effetti termoelettrici
Appunti: Le leggi di Volta
Appunti: Estrazione di elettroni dai metalli
