Le pile, o celle elettrolitiche, sono generatori di tensione che sfruttano soluzioni elettrolitiche per compiere lavoro; esse utilizzano l’energia potenziale chimica delle soluzioni per produrre energia elettrica.
Le soluzioni utilizzate sono poste in due recipienti diversi, collegati tra loro da un ponte salino, oppure divisi divisi da una membrana semipermeabile, che permette solo il passaggio di determinate sostanze; all’interno delle soluzioni, poi, sono poste delle lamine metalliche, gli elettrodi.
A differenza delle celle elettrolitiche, in questo caso il polo negativo viene detto anodo, mentre quello positivo si dice catodo.
Esaminiamo il funzionamento delle pile con un esempio pratico.
Consideriamo una soluzione liquida di solfato di rame, in cui viene immersa una barretta di zinco. Dopo un certo periodo di tempo, la barretta si ricopre di uno strato di rame metallico, assumendo così un colore rossiccio; la temperatura della soluzione, inoltre, risulta aumentata.
La situazione può essere spiegata in termini chimici, parlando di reazioni di ossido-riduzione, nelle quali una specie chimica acquista elettroni, mentre l’altra li cede.
In questo caso, lo zinco si ossida e cede due elettroni al rame, mentre quest’ultimo si riduce acquistando due elettroni (e diventando, così, uno ione positivo).
La reazione chimica, in questo caso, avviene spontaneamente, e pertanto vi è una produzione di calore; la reazione, quindi, si dice esotermica.
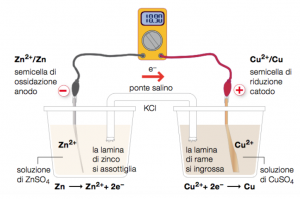
La pila, quindi, sfrutta le reazioni di ossido-riduzione per trasformare l’energia chimica della reazione spontanea in energia elettrica. Il suo funzionamento, però, prevede che le due reazioni, quella di ossidazione e quella di riduzione, avvengano separatamente.
Si posizionano, in questo caso, una barretta di zinco in una soluzione di solfato di zinco, e una barretta di rame in una soluzione di solfato di rame.
Le due soluzioni, poi, vengono collegate con un ponte salino, che permette solo il passaggio di determinate sostanze, che non influenzino le reazioni di ossidoriduzione; queste sostanze permettono di ristabilite un equilibrio delle cariche, trasportando elettroni da una soluzione all’altra.
Le barrette metalliche, invece, sono collegate da un filo conduttore, che permette il passaggio degli elettroni; in questo caso, lo zinco perde elettroni e la barretta di zinco si assottiglia; il filo conduttore permette il passaggio degli elettroni da una soluzione all’altra, e nella seconda, gli elettroni vengono acquistati dal rame, cosicché la barretta di rame diventa più spessa.
Le pile a secco
Le cosiddette “pile a secco” sono un particolare tipo di pila, definite in questo modo perché la pila di Volta, la prima pila inventata, era costituita da una serie di dischi di rame e zinco separati tra loro da un panno inumidito imbevuto di un conduttore elettrolitico.
Le pile a secco, invece, sono ad esempio le pile in zinco-carbone, le classiche pile di uso quotidiano.
Queste pile sono costituite da un rivestimento di zinco all’interno del quale sono presenti, in ordine, una soluzione elettrolitica, uno strato di diossido di manganese, e un cilindro di grafite.
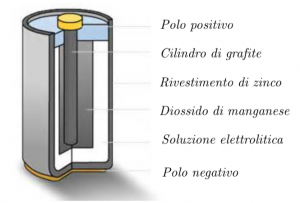
Il funzionamento di queste pile si basa sempre su reazioni di ossidoriduzione; lo zinco tende a perdere elettroni, che vengono attratti nella soluzione elettrolitica, concentrata in uno dei due estremi della pila; a causa dell’eccesso di elettroni presenti, questa parte diventerà il polo negativo della pila. Il carbone, invece, tende a cedere elettroni al diossido di manganese, cosicché l’altro estremo diviene il polo positivo.
Potrebbero interessarti
Video Lezioni: Elettromagnetismo
Vide Lezioni: Onde e Luce
Appunti: La corrente elettrica nei liquidi
Appunti: I raggi catodici
Appunti: L’elettrolisi e le leggi di Faraday
Appunti: Gli effetti termoelettrici
Appunti: Le leggi di Volta
Appunti: Estrazione di elettroni dai metalli
