I legami chimici
Gli atomi che compongono la materia sono legati tra loro da forze attrattive tra le particelle elementari, che costituiscono il legame chimico.
Ogni legame può essere rotto, e per farlo occorre vincere queste orze attrattive; occorre fornire, quindi, un’energia sufficiente a vincere tali forze. Questa energia prende il nome di energia di legame, ed è pari alla differenza tra l’energia complessiva degli atomi isolati e a quella complessiva dell’aggregato molecolare.
Tra i legami chimici più diffusi troviamo il legame covalente, che prevede la condivisione da parte di due atomi di una o sue coppie di elettroni.
Dal punto di vista della fisica quantistica, il legame covalente può essere descritto considerando la funzione d’onda ψ.
Nel caso più semplice, quello dell’idrogeno, la molecola di idrogeno H2 è composta da due atomi, ciascuno dei quali mette in condivisione un elettrone.
Legami chimici e funzione d’onda
Se osserviamo il fenomeno dal punto di vista della fisica quantistica, possiamo considerare la probabilità che si ha di trovare un elettrone in una determinata regione di spazio.
Sapendo che la probabilità di osservare la particella in quella determinata regione è proporzionale al quadrato di ψ, e considerando uguali le probabilità di trovare l’elettrone in una regione ∆V per entrambi gli atomi di H, possiamo stabilite che l’ampiezza di probabilità può essere di due tipi: nel caso in cui la funzione ψ sia pari, e nel caso in cui ψ dia dispari.
Il primo caso si ha quando ψ in due punti simmetrici ha lo stesso modulo e lo stesso segno, mentre nel secondo caso la funzione assume uguale modulo, ma segno opposto.
Dallo studio dei grafici delle funzioni ψ pari e dispari, emerge che nel caso della funzione dispari, l’elettrone ha una bassa probabilità di trovarsi nella regione di spazio centrale della molecola, compresa tra i due atomi; nel secondo caso, invece, per funzioni pari, l’elettrone ha alte probabilità di trovarsi in tale regione, in quanto sono presenti forze attrattive intense dovute alla presenza delle cariche positive.
La funzione pari, quindi, che è quella a più bassa energia per l’elettrone, mostra che la probabilità di trovare l’elettrone nella regione di spazio centrale è molto elevata; tale funzione, quindi, è quella che descrive un elettrone maggiormente attratto, e più coinvolto nel legame:
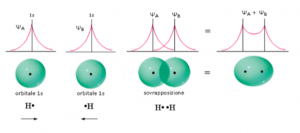
Possiamo osservare che quando gli atomi sono nello stato fondamentale, isolati, gli elettroni sono descritti da una funzione d’onda che circonda il nucleo atomico.
Quando, però, gli atomi vengono avvicinati, si ha come uno sdoppiamento dei livelli di energia; si sovrappongono, infatti, due stati energetici differenti, uno a energia minore dato dalla funzione d’onda pari, e l’altro a energia maggiore dato dalla funzione d’onda dispari.
Caso del reticolo cristallino
Le considerazioni precedenti possono essere estese al caso di più atomi legati tra loro, come avviene per esempio in un reticolo cristallino.
Finché gli atomi (dello stesso tipo) si trovano lontani e separati, ciascuno di essi possiede lo stesso livello energetico; quando gli atomi vendono avvicinati, ogni livello energetico si scinde in un certo numero di livelli energetici differenti, se pur molto simili; il numero di livelli energetici che si forma è dato dal numero di atomi che vengono raggruppati.
Poiché un cristallo è formato da un numero grandissimo di atomi, i livelli energetici che si formano saranno talmente vicini tra loro da formare come una “banda” energetica continua.
In base alle bande energetiche possedute dai vari elementi, possiamo classificarli in conduttori o isolanti.
Infatti, negli elementi che possiedono delle bande energetiche piene non vi sono elettroni liberi di muoversi, in quanto tutti i livelli energetici sono occupati.
Nel caso in cui, invece, vi siano bande energetiche parzialmente piene, è più facile che gli elettroni passino a livelli energetici superiori, creando così una corrente elettrica.
Potrebbero Interessarti
VideoLezioni: La meccanica quantistica
Appunti: La legge di Planck
Appunti: L’effetto fotoelettrico e l’ipotesi di Einstein
Appunti: L’effetto Compton
Appunti: L’energia atomica e il modello di Bohr
Appunti: Il principio di indeterminazione di Heisenberg
Appunti: I numeri quantici
Appunti: I semiconduttori
Appunti: Dispositivi a semiconduttori
